Los fagos como alternativa a los antibióticos: el enemigo de mi enemigo, es mi amigo
- Pablo Catalá Gregori

Introducción
La terapia antibiótica es necesaria para mejorar el bienestar animal y la salud del consumidor final. La aparición de resistencias antimicrobianas ha implicado la limitación del uso de antibióticos, tanto por una menor efectividad como por una mayor restricción legal. Cabe recordar que el uso de antibióticos no es la única causa de la aparición de las resistencias antimicrobianas, siendo el medio ambiente donde se encuentran las bacterias otro de los factores a tener en cuenta. Se han aislado gérmenes multirresistentes en animales silvestres, que no han tenido un contacto directo con los antibióticos. En este contexto, la búsqueda de alternativas para controlar las poblaciones bacterianas es uno de los retos a los que se enfrenta la producción animal y la medicina humana.
Una de las alternativas más prometedoras es la terapia fágica o fagoterapia. No es una alternativa nueva, pues se descubrió antes que la terapia antibiótica, pero ha permanecido olvidada por el mundo occidental, en parte gracias al éxito de los antibióticos.
Antecedentes
El descubrimiento y empleo masivo de las terapias antibióticas y las vacunas son los avances científicos que han salvado más vidas en la historia de la humanidad.

El uso efectivo y generalizado de los antibióticos tras la II Guerra Mundial, junto con las dificultades tecnológicas de estandarización de los preparados fágicos puros para demostrar resultados concluyentes, el desconocimiento de la biología y la farmacodinámica de los mismos, condujeron al abandono de la fagoterapia. Sin embargo, se siguieron empleando en los países del antiguo bloque soviético, siendo actualmente una terapia rutinaria en países como Rusia, Polonia o Georgia. A finales del 2018 pude personalmente adquirir, sin receta y de forma legal, un preparado de bacteriófagos en forma de gel para tratar infecciones de la piel, en una farmacia de Nizni Nóvgorod, la quinta ciudad más poblada de Rusia, a un precio equivalente de unos 10 €. Por otra parte, en EEUU ya se comercializan como preventivo sobre alimentos envasados. Es de prever que la regulación europea ampare el uso generalizado de los bacteriófagos en un futuro cercano, dada la experiencia de otros países, la financiación de varios proyectos de investigación con fondos europeos y el sentido común. La fundación Bill & Melinda Gates ha apoyado diversas acciones para el desarrollo de la fagoterapia. Además, la EFSA ya ha emitido opiniones favorables sobre su uso en alimentos.
Los antibióticos fueron el origen del declive del uso de los bacteriófagos, y son ahora la causa de su resurgimiento.
Descubrimiento
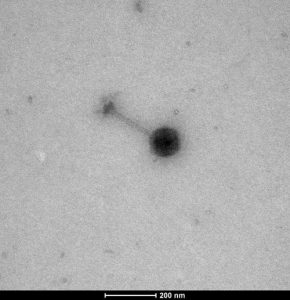
El término “bacteriófago” proviene de las palabras “bacteria” y “fagein” (del griego comer) y fue propuesto por Félix d’Hérelle. Previamente, el británico Ernest Hankin (1896) en sus estudios sobre el cólera y el ruso Nikolay Gamaleya (1898) en sus trabajos sobre el carbunco, lo denominaron como una sustancia no identificada con posible actividad antibacteriana. El británico Frederick Twort fue el primero en reportar su capacidad lítica en 1915 pero no profundizó más. El potencial uso de estas entidades bacteriolíticas transmisibles para el tratamiento de infecciones se describió por el franco-canadiense Félix d´Hérelle en 1917, cuando el término “bacteriófago” fue presentado por él en el Instituto Pasteur de Paris, durante sus investigaciones sobre disentería en soldados franceses de la I Guerra Mundial.
A principios de 1919 Félix d’Hérelle aisló bacteriófagos de heces de pollo y los usó con éxito en el tratamiento de la tifosis aviar causada por Salmonella Gallinarum. Estos buenos resultados fueron los precursores del primer ensayo en humanos, que llevó a cabo ese mismo verano para tratar un caso de disentería. Cuando la terapia fágica sea aceptada globalmente como una terapia más para controlar las infecciones bacterianas, podremos afirmar que la avicultura colaboró en ello hace ahora 100 años.
George Eliava fundó el Eliava Institute en 1923 en Tbilisi, Georgia, y Félix d’Hérelle colaboró en el desarrollo del mismo. Actualmente está activo como el Eliava Institute of Bacteriophages, Microbiology and Virology (IBMV), contando con 130 empleados.
Clasificación
El primero en observarlos directamente fue el médico alemán Helmut Ruska gracias al microscopio electrónico, en 1939. Su taxonomía se basa en el genoma y la morfología del virión. Actualmente se reconocen 873 especies, 204 géneros y 14 subfamilias. El 96% de los bacteriófagos conocidos pertenecen a 3 familias: Myoviridae, Podoviridae y Siphoviridae, todas ellas pertenecientes al orden de los Caudovirales. De ahí que todos tengamos en mente la morfología de los bacteriófagos como virus con cola. En el caso de las familias Myoviridae y Siphoviridae son colas largas, contráctiles en la primera y no contráctiles en la segunda. En el caso de Podoviridae son colas cortas no contráctiles.
Relevancia en el ecosistema
Los bacteriófagos son las estructuras biológicas más abundantes en el planeta, muy primitivas y sencillas, estimándose su número en 1030 a 1032 en el ambiente, teniendo un papel muy importante manteniendo el equilibrio microbiológico de este. Representan un necesario mecanismo de control de las bacterias marinas, ya que se produce un equilibrio entre las bacterias que se multiplican y los bacteriófagos que destruyen una parte de esa población bacteriana. Se estima que cada día destruyen entre el 20 y el 40% de las bacterias marinas. Otras fuentes describen que cada 48 horas la mitad de la población bacteriana mundial es destruida por los bacteriófagos. El ser más mortal del planeta puede convertirse en nuestro aliado. Viven en equilibrio con las bacterias, su organismo diana. Son naturales, específicos y autolimitantes.
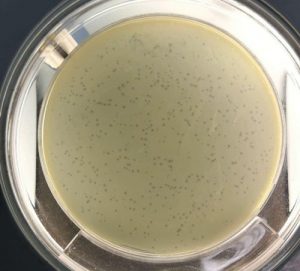
Son naturales: se aíslan del ecosistema, no se sintetizan artificialmente (al menos no de forma generalizada por el momento). Podemos asimilarlo a un agente de lucha biológica que lleva millones de años de evolución luchando contra las bacterias, aprovechémoslo. Se aíslan, se multiplican y se aplican en un número que les permite romper el equilibrio con las poblaciones bacterianas diana, a favor del bacteriófago. Les podríamos pegar, en letras grandes, una etiqueta de “BIO” o “ECO”.
Son específicos: a diferencia de los antibióticos, son específicos de la bacteria diana, no afectando al resto de bacterias, ni beneficiosas ni patógenas. Adiós a las disbiosis por destrucción de la microbiota comensal. Por ejemplo, podemos tener un bacteriófago simultáneamente activo frente a una cepa de Salmonella Enteritidis y una cepa Salmonella Typhimurium, pero no ser activo frente a otra cepa de Salmonella Enteritidis, aislada de la misma explotación. Las dos primeras compartirían los receptores específicos de ese bacteriófago, y la tercera no. Hay que recordar que los antígenos que empleamos para clasificar los serotipos de Salmonella son independientes de los receptores fágicos. Por otra parte, los bacteriófagos solo tienen receptores para las células procariotas, no tienen receptores para las células eucariotas. Son inocuos para los animales, incluido el ser humano.
Son autolimitantes: son de replicación autolimitante y eliminan su acción cuando no queda bacteria huésped.
Los animales y los humanos están en contacto permanente con los bacteriófagos, son consumidos regularmente junto con los alimentos, son colonizadores habituales del intestino y son muy abundantes en el ecosistema. Por ello, la respuesta inmunogénica frente a ellos no debería ser un limitante, y aunque exista, la cinética de los bacteriófagos sería superior a la de producción de anticuerpos neutralizantes.
Modo de acción
La eficacia de los bacteriófagos está determinada por la concentración en la que se encuentren, el tipo de ciclo de vida y la forma y tiempo de aplicación de los mismos. La capacidad de actuar como agentes bactericidas se debe a su ciclo de vida. Generalmente, los bacteriófagos pueden realizar dos tipos de ciclo de desarrollo: lítico (finaliza con la lisis de la bacteria infectada) o lisogénico (el genoma del bacteriófago es insertado en el genoma de la bacteria). Únicamente aquellos bacteriófagos capaces de realizar un ciclo lítico producen la eliminación eficaz de las bacterias, por lo que son los que interesan en la terapia fágica. En el ciclo lítico el bacteriófago se adhiere a la bacteria, inyecta su material genético, dirige la expresión de los genes responsables de la replicación del genoma viral, se multiplica y lisa la pared celular (gracias a las endolisinas), acabando con la bacteria y saliendo los nuevos bacteriófagos al medio extracelular al encuentro de nuevas bacterias diana. Las holinas crean poros en la membrana celular por los que las endolisinas llegan al espacio periplásmico y se unen al peptidoglucano de la pared bacteriana, rompiendo los enlaces requeridos para su estabilidad, alterando su equilibrio osmótico y produciendo así la lisis hipotónica de la bacteria. La sucesiva liberación de nuevos bacteriófagos permite la infección de nuevas bacterias diana de forma exponencial.
Aplicaciones
Podemos diferenciar dos usos de los bacteriófagos en avicultura:
- como agentes de biocontrol, higienizantes de superficies o preventivos.
- como alternativa a los antibióticos, terapia fágica o terapéuticos.
Las bacterias más importantes en avicultura son Salmonella, Campylobacter y E. coli, por motivos de salud pública o sanidad animal. Podríamos añadir Clostridium a esta triada.
En el caso de Salmonella se puede plantear un uso como preventivo, higienizando la explotación mediante la aplicación de bacteriófagos específicos frente a las cepas aisladas previamente. Se aplican vía pulverización sobre las superficies, tras la limpieza. Esta misma prevención se podría llevar a cabo sobre las canales de aves y las superficies de los equipos de los mataderos.
Es relevante recordar que los bacteriófagos pueden actuar eliminando el biofilm. La fagoterapia terapéutica sería otra opción, pero los bacteriófagos administrados vía oral en agua o aditivo en pienso, o incluso pulverizando sobre los animales, a diferencia de los aplicados en superficies, deben ir microencapsulados para evitar la pérdida de actividad por el bajo pH del proventrículo y la molleja. En este sentido, el microencapsulamiento en liposomas les permitiría acceder al interior de las células eucariotas al encuentro de bacterias con capacidad de colonización intracelular, como la Salmonella.
Campylobacter es una bacteria mucho menos resistente en el ambiente que Salmonella, por lo que la aproximación sería preventiva sobre las canales y puntos críticos en matadero y terapéutica en explotación.
Las colibacilosis y las clostridiosis se podrían abordar desde una estrategia preventiva y terapéutica sobre el animal, sin olvidar la aplicación respiratoria, vía aerosol, en el caso de E. coli.
Los protocolos de aplicación se adaptan a cada caso, e incluyen dosis, vía y forma de aplicación, así como el número de aplicaciones y verificación de la efectividad de la actuación.
En el gel ruso comentado anteriormente, de uso humano, el cóctel contenía más de 40 bacteriófagos. La aplicación de cócteles de bacteriófagos es la vía comúnmente empleada para su uso en animales y humanos. A partir de una fagoteca, se seleccionan los fagos activos frente al patógeno mediante un fagograma, se combinan en una mezcla o cóctel y se administran. Por experiencias previas se van ajustando las composiciones de estos cócteles, de manera a poder almacenar los mejores, y recomendar uno frente a una patología, aún sin aislar el agente patógeno. Pero al igual que con los antibióticos, se han descrito resistencias bacterianas tras la aplicación cócteles de bacteriófagos en avicultura. La velocidad de generación de estas resistencias es menor que en el caso de los antibióticos y la facilidad de aislar un nuevo bacteriófago eficaz es mayor que los recursos necesarios para encontrar una nueva molécula antibiótica. Aquí es donde introducimos un nuevo concepto, el autobacteriófago o autofago. Definimos un autofago como un bacteriófago aislado directamente del mismo medio donde se encuentra la bacteria diana (recordemos que donde hay bacteria, hay bacteriófago efectivo contra ella), creando así una solución más efectiva y específica que un cóctel de bacteriófagos comerciales. El concepto de especificidad podría aquí asimilarse al de las autovacunas.
Retos y perspectivas de futuro
No serán la panacea ni la solución final a las infecciones bacterianas, pero su futuro es muy prometedor como herramienta complementaria a las ya existentes en las explotaciones avícolas: bioseguridad, limpieza y desinfección, vacunación, autocontrol, y como no, la antibioterapia, que deberá seguir estando disponible.
Resultaría atractivo el evaluar el efecto de combinar los bacteriófagos con otras alternativas, como, por ejemplo:
- bacteriófagos + endolisinas (o enzibióticos): Se evaluaría la sinergia entre la capacidad replicativa del bacteriófago y la efectividad de las endolisinas para romper las paredes celulares bacterianas.
- bacteriófagos + bacterias beneficiosas o probióticos: Se aprovecharía la exclusión competitiva de los complejos bacterianos (por ej. Bacillus y Lactobacillus) ejercida sobre las bacterias patógenas y la especificidad de los fagos frente a la bacteria diana.
- fagos + antibióticos: se ha reportado la existencia de la reversión de la resistencia antimicrobiana en cepas bacterianas tratadas con fagos. Al parecer, la bacteria adapta su metabolismo para hacer frente a los fagos, y esta modificación, afecta a su capacidad de hacer frente a los antibióticos, en algunos casos.
Los retos a los que se enfrenta la fagoterapia son la regulación, la aceptación social, la prevención del uso de virus de ciclos lisogénicos, la evaluación de la producción de endotoxinas tras la lisis celular, la respuesta inmune y la identificación del riesgo de transmisión de genes de antibiorresistencia o virulencia entre bacterias.
La elevada especificidad de los bacteriófagos por la bacteria diana, la ratio coste-beneficio, la fácil administración y los pocos riesgos que presentan sobre el animal, hacen de la terapia fágica una solución prometedora para el control de Salmonella, Campylobacter, E. coli y Clostridium, sin descartar cualquier otra patología causada por bacterias.
El enemigo de mi enemigo, es mi amigo.
Pablo Catalá Gregori
Director Gerente CECAV